2021年人工智能助力中小企业创新发展优秀案例五:微尺度工业设计平台项目

【本期案例】 北京深势科技有限公司:微尺度工业设计平台项目
深势科技深耕“AI for Science”领域,创新性的融合了跨尺度建模、高效采样、高性能计算等技术,打造出基于新一代分子模拟算法的微尺度工业设计平台,将传统分子模拟算法的计算速度提升了至少五个数量级,从而实现了以量子力学精度模拟数十亿原子规模的体系,从而解决药物和材料分子的计算模拟难题,颠覆现有研发范式,打造“计算指导实验、实验反馈设计”的全新范式,在创新药和新材料研发领域具有很好的应用前景。
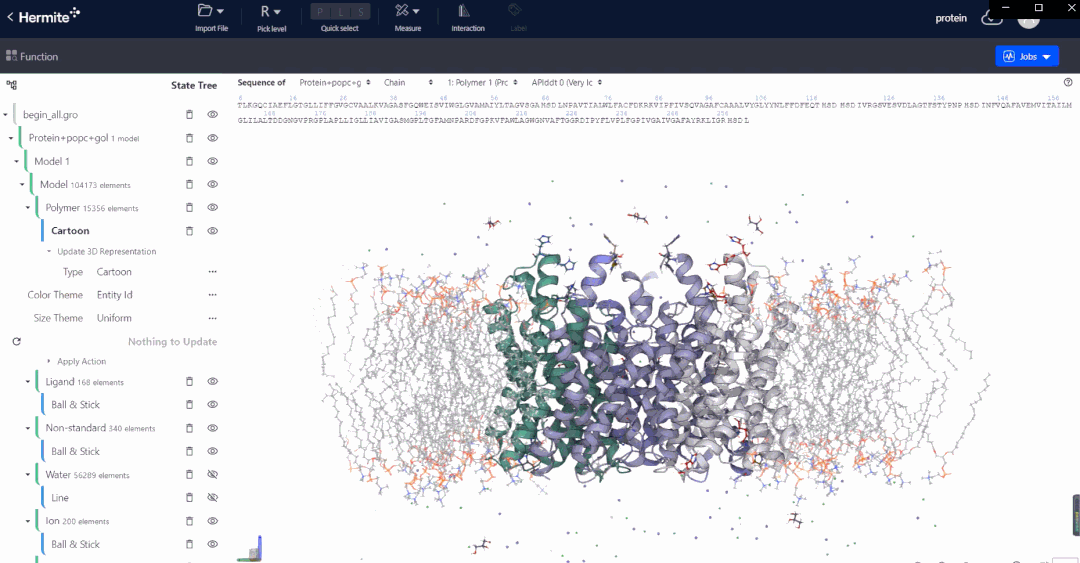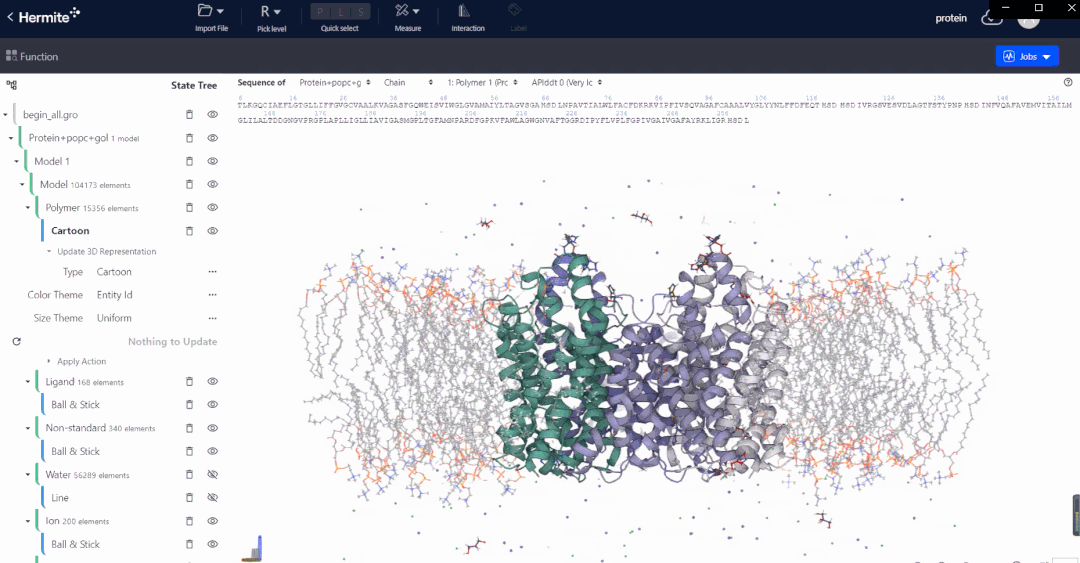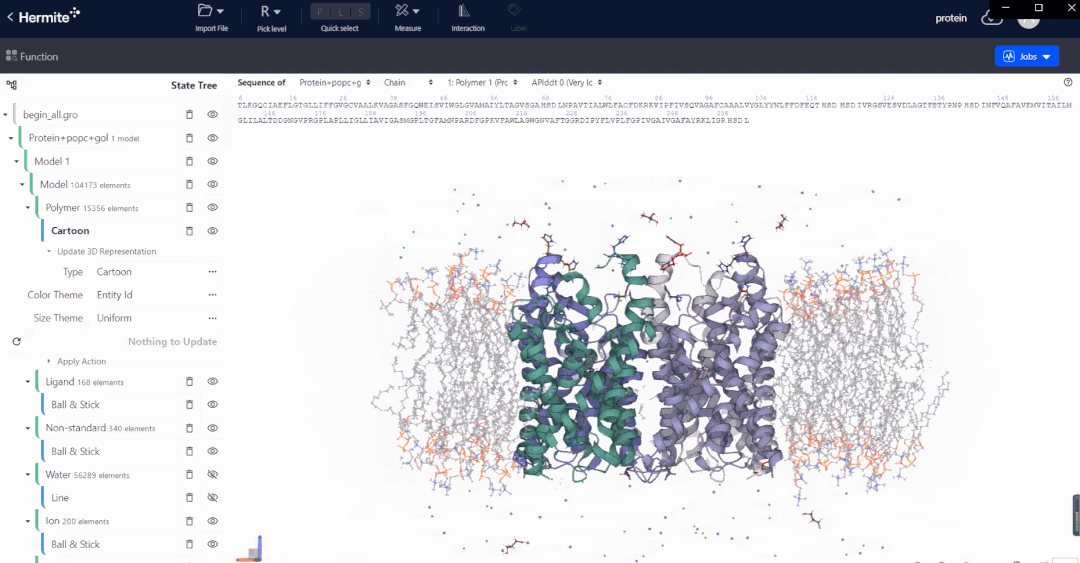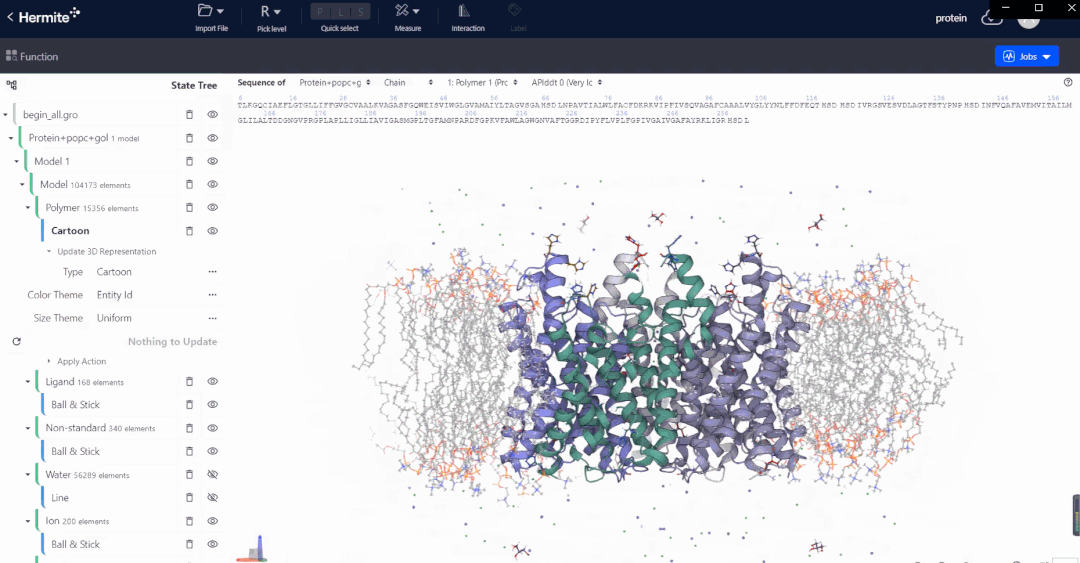
Hermite™是深势科技微尺度工业设计平台在药物研发领域的行业应用平台。Hermite™基于人工智能、物理建模和高性能计算,可以提供多种药物设计功能,帮助药物设计人员完成从靶点结构解析、预测与精修,到苗头化合物筛选,再到先导化合物优化和性质预测的一体化工作。
1.蛋白结构预测——Uni-Fold
Uni-Fold是基于深度学习的蛋白质结构预测模块,从蛋白一级序列出发可以精准而快速的预测蛋白质的3D结构。Uni-Fold成功复现曾引起生物学界轰动的 AlphaFold2 的全规模训练,并在训练与推理环节进行了 NVIDIA GPU上的适配、性能优化及功能完善等工作。使用 Uni-Fold对最新一届全球蛋白质结构预测竞赛CASP14 中的序列数据集进行的测试结果表明:在相同测试条件下,Uni-Fold预测结果的平均 Cα-lDDT,其精度和效率均超越了AlphaFold2。
在实际的基于结构出发的药物设计开发工作中,以Uni-Fold预测的初始结构为起点,配合深势科技AI赋能的RiD增强采样算法,可进一步对结构进行精修和优化,深度赋能传统无结构靶标的药物发现,为结构生物学领域带来全新的发展思路。
2.精确预测蛋白-配体结合自由能——Uni-FEP
Uni-FEP能够精准预测药靶结合自由能,提升先导化合物优化的效率。Uni-FEP将自由能微扰理论、分子动力学、增强采样算法与高性能计算相结合,以化学精度(1 kcal/mol,约5-6倍活性差异以内)高效评估蛋白质与配体的结合亲和力,适用于R基团优化、骨架跃迁、电荷转移、大环成环等各种不同的优化场景。
3.基于AI的增强采样算法——RiD
RiD(Reinforced Dynamics)是Hermite平台中的基于增强采样的分子动力学模拟模块。借助神经网络能够处理几十甚至上百维的集合变量,大大降低了CV选取的敏感性,使得增强采样方法能够应用在复杂蛋白体系中。RiD广泛适用于蛋白质结构精修、蛋白质构象变化、药物与蛋白结合过程等场景。RiD利用机器学习拟合高维自由能面,对高维空间进行高效采样,已经被成功用于解决蛋白折叠、蛋白结构优化、别构口袋预测等场景中的复杂采样问题,实现蛋白质动力学、蛋白受体结合构象的高效预测和精准优化。
4.高效的虚拟筛选引擎
基于云的Hermite SaaS平台,可在短时间内调度海量算力资源,一天内即可完成1200万分子的筛选。提供超过1200万可采买的化合物库用于高通量虚拟筛选,可以帮助药物设计人员快速筛选、富集潜在的苗头化合物。Hermite虚拟筛选流程支持柔性对接,包括支持蛋白柔性和配体柔性,帮助药物设计人员更精准的确认苗头化合物或先到化合物与靶点的结合模式和作用机理。独一无二的“引导式”操作模式,满足CADD专家筛选的同时,让“零基础”的药物化学家也可以实现虚拟筛选。